Categorías: Artículos destacados » Electricistas novatos
Cantidad de vistas: 52646
Comentarios sobre el artículo: 4
Transistores Parte 2. Conductores, aisladores y semiconductores.
Comienzo del artículo: Historia del transistor, Transistores: finalidad, dispositivo y principios de funcionamiento.
 En ingeniería eléctrica, se utilizan diversos materiales. Las propiedades eléctricas de las sustancias están determinadas por el número de electrones en la órbita de valencia externa. Cuantos menos electrones haya en esta órbita, cuanto más débiles estén asociados con el núcleo, más fácil será viajar.
En ingeniería eléctrica, se utilizan diversos materiales. Las propiedades eléctricas de las sustancias están determinadas por el número de electrones en la órbita de valencia externa. Cuantos menos electrones haya en esta órbita, cuanto más débiles estén asociados con el núcleo, más fácil será viajar.
Bajo la influencia de las fluctuaciones de temperatura, los electrones se separan del átomo y se mueven en el espacio interatómico. Dichos electrones se llaman libres y crean una corriente eléctrica en los conductores. ¿Hay un gran espacio interatómico, hay espacio para que los electrones libres viajen dentro de la materia?
La estructura de sólidos y líquidos parece continua y densa, que recuerda la estructura de una bola de hilo. Pero, de hecho, incluso los sólidos son más como una red de pesca o voleibol. Por supuesto, esto no puede discernirse a nivel doméstico, pero se ha establecido mediante estudios científicos precisos que las distancias entre los electrones y el núcleo de los átomos son mucho mayores que sus propias dimensiones.
Si el tamaño del núcleo atómico se presenta en forma de una pelota del tamaño de una pelota de fútbol, entonces los electrones en este modelo serán del tamaño de un guisante, y cada uno de estos guisantes se ubicará desde el "núcleo" a una distancia de varios cientos e incluso miles de metros. Y entre el núcleo y el electrón hay vacío: ¡simplemente no hay nada! Si imaginamos las distancias entre los átomos de materia en la misma escala, las dimensiones resultarán fantásticas: ¡decenas y cientos de kilómetros!
Los buenos conductores de electricidad son metales. Por ejemplo, los átomos de oro y plata tienen solo un electrón en la órbita externa, por lo tanto, son los mejores conductores. El hierro también conduce electricidad, pero un poco peor.
Conducir la electricidad aún peor aleaciones de alta resistencia. Estos son nicrom, manganin, constantan, fechral y otros. Tal variedad de aleaciones de alta resistencia se debe al hecho de que están diseñadas para resolver varios problemas: elementos calefactores, galgas extensométricas, resistencias de referencia para instrumentos de medición y mucho más.
Para evaluar la capacidad de un material para conducir electricidad, el concepto de "Conductividad eléctrica". El valor de retorno es resistividad. En mecánica, estos conceptos corresponden a la gravedad específica.
Aisladores, a diferencia de los conductores, no están inclinados a perder electrones. En ellos, el enlace del electrón con el núcleo es muy fuerte y casi no hay electrones libres. Más precisamente, pero muy pocos. Al mismo tiempo, en algunos aisladores hay más y su calidad de aislamiento es, en consecuencia, peor. Es suficiente comparar, por ejemplo, cerámica y papel. Por lo tanto, los aisladores se pueden dividir condicionalmente en buenos y malos.
La aparición de cargas libres incluso en los aisladores se debe a las vibraciones térmicas de los electrones: bajo la influencia de la alta temperatura, las propiedades aislantes se deterioran, algunos electrones aún logran separarse del núcleo.
Del mismo modo, la resistividad de un conductor ideal sería cero. Pero afortunadamente no existe tal conductor: ¡imagínese cómo se vería la ley de Ohm ((I = U / R) con cero en el denominador! Adiós a las matemáticas y la ingeniería eléctrica.
Y solo a una temperatura cero absoluta (-273.2 ° C) las fluctuaciones térmicas se detienen por completo, y el peor aislante se vuelve lo suficientemente bueno. Para determinar numéricamente "esto" es malo - buen uso del concepto de resistividad. Esta es la resistencia en ohmios de un cubo con una longitud de borde de 1 cm, la dimensión de la resistividad se obtiene en ohmios / cm. La resistencia específica de algunas sustancias se muestra a continuación.La conductividad es el recíproco de la resistividad, es la unidad de medida de Siemens, - 1Sm = 1 / Ohm.
Tienen buena conductividad o baja resistividad: plata 1.5 * 10 ^ (- 6), lea cómo (uno y medio a diez a la potencia menos seis), cobre 1.78 * 10 ^ (- 6), aluminio 2.8 * 10 ^ (- 6). La conductividad de las aleaciones con alta resistencia es mucho peor: constantan 0.5 * 10 ^ (- 4), nicrom 1.1 * 10 ^ (- 4). Estas aleaciones pueden llamarse malos conductores. Después de todos estos números complejos, sustituya Ohm / cm.
Además, los semiconductores se pueden distinguir como un grupo separado: germanio 60 ohmios / cm, silicio 5000 ohmios / cm, selenio 100 000 ohmios / cm. La resistividad de este grupo es mayor que la de los malos conductores, pero menor que la de los malos aisladores, sin mencionar los buenos. Probablemente, con el mismo éxito, los semiconductores podrían llamarse semi-aislantes.
Después de tan poco conocimiento de la estructura y las propiedades de un átomo, uno debería considerar cómo los átomos interactúan entre sí, cómo los átomos interactúan entre sí, cómo están hechas las moléculas de ellos, de los cuales se componen varias sustancias. Para hacer esto, nuevamente tendrá que recordar los electrones en la órbita externa del átomo. Después de todo, son ellos quienes participan en la unión de los átomos en las moléculas y determinan las propiedades físicas y químicas de la materia.
Como los átomos están hechos de átomos
Cualquier átomo está en un estado estable si hay 8 electrones en su órbita externa. No busca tomar electrones de los átomos vecinos, pero no abandona los suyos. Para verificar esto, es suficiente en la tabla periódica observar los gases inertes: neón, argón, criptón, xenón. Cada uno de ellos tiene 8 electrones en la órbita externa, lo que explica la renuencia de estos gases a entrar en cualquier relación (reacciones químicas) con otros átomos, para construir moléculas de sustancias químicas.
La situación es bastante diferente para aquellos átomos que no tienen 8 electrones apreciados en su órbita externa. Dichos átomos prefieren unirse con otros para complementar su órbita externa con hasta 8 electrones y encontrar un estado estable y tranquilo.
Por ejemplo, la conocida molécula de agua H2O. Consiste en dos átomos de hidrógeno y un átomo de oxígeno, como se muestra en la figura. 1.
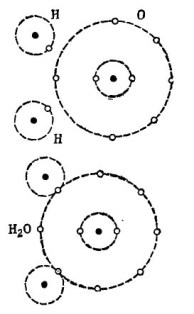
Dibujo 1. Cómo se crea una molécula de agua.
En la parte superior de la figura, dos átomos de hidrógeno y un átomo de oxígeno se muestran por separado. Hay 6 electrones en la órbita externa de oxígeno y dos electrones en dos átomos de hidrógeno están cerca. Oxígeno hasta que al preciado número 8 le falten solo dos electrones en la órbita externa, que recibirá al agregar dos átomos de hidrógeno a sí mismo.
Cada átomo de hidrógeno carece de 7 electrones en su órbita externa para una felicidad completa. El primer átomo de hidrógeno recibe en su órbita exterior 6 electrones del oxígeno y otro electrón de su gemelo, el segundo átomo de hidrógeno. Ahora hay 8 electrones en su órbita exterior junto con su electrón. El segundo átomo de hidrógeno también completa su órbita exterior hasta el número 8. Este proceso se muestra en la parte inferior de la figura. 1.
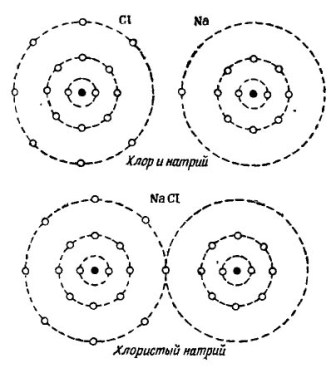
En la foto 2 Se muestra el proceso de combinar átomos de sodio y cloro. El resultado es cloruro de sodio, que se vende en tiendas llamadas sal.
Dibujo 2. El proceso de combinar átomos de sodio y cloro.
Aquí, también, cada uno de los participantes recibe el número faltante de electrones del otro: el cloro une un solo electrón de sodio a sus propios siete electrones, mientras le da sus átomos al átomo de sodio. Ambos átomos en la órbita externa tienen 8 electrones, que es donde se logra el pleno acuerdo y la prosperidad.
Valencia de los átomos
Los átomos con 6 o 7 electrones en su órbita exterior tienden a unir 1 o 2 electrones a sí mismos. Dicen acerca de tales átomos que son uno o divalentes. Pero si en la órbita externa de un átomo 1, 2 o 3 electrones, ese átomo tiende a desprenderse. En este caso, el átomo se considera uno, dos o trivalente.
Si hay 4 electrones en la órbita externa de un átomo, entonces dicho átomo prefiere combinarse con el mismo, que también tiene 4 electrones. Así es como se combinan los átomos de germanio y silicio utilizados en la producción de transistores. En este caso, los átomos se llaman tetravalentes. (Los átomos de germanio o silicio se pueden combinar con otros elementos, por ejemplo, oxígeno o hidrógeno, pero estos compuestos no son interesantes en el plan de nuestra historia).
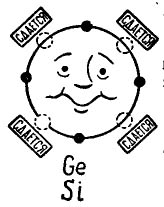
En la foto 3 se muestra un átomo de germanio o silicio que desea combinar con el mismo átomo. Los pequeños círculos negros son los propios electrones del átomo, y los círculos de luz indican los lugares donde caen los electrones de los cuatro átomos, vecinos.
Dibujo 3. Átomo de germanio (silicio).
La estructura cristalina de los semiconductores.
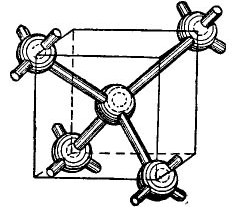
Los átomos de germanio y silicio en la tabla periódica están en el mismo grupo con el carbono (la fórmula química del diamante C es simplemente cristales de carbono grandes obtenidos bajo ciertas condiciones) y, por lo tanto, cuando se combinan, forman una estructura cristalina similar a un diamante. La formación de dicha estructura se muestra, de forma simplificada, por supuesto, en la figura. 4.
Dibujo 4.
En el centro del cubo hay un átomo de germanio, y 4 átomos más se encuentran en las esquinas. El átomo representado en el centro del cubo está unido por sus electrones de valencia a sus vecinos más cercanos. A su vez, los átomos angulares dan sus electrones de valencia al átomo ubicado en el centro del cubo y sus vecinos, átomos que no se muestran en la figura. Por lo tanto, las órbitas externas se complementan con hasta ocho electrones. Por supuesto, no hay un cubo en la red cristalina, solo se muestra en la figura para que la disposición mutua y volumétrica de los átomos sea clara.
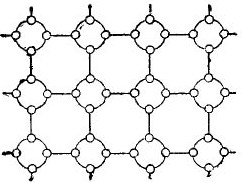
Pero para simplificar la historia de los semiconductores tanto como sea posible, la red cristalina se puede representar en forma de un dibujo esquemático plano, a pesar de que los enlaces interatómicos están ubicados en el espacio. Tal circuito se muestra en la figura. 5.
Dibujo 5. La red cristalina de germanio en forma plana.
En dicho cristal, todos los electrones están firmemente unidos a los átomos por sus enlaces de valencia, por lo tanto, aparentemente, simplemente no hay electrones libres aquí. Resulta que frente a nosotros hay un aislante en la figura, ya que no contiene electrones libres. Pero, de hecho, esto no es así.
Conductividad intrínseca
El hecho es que, bajo la influencia de la temperatura, algunos electrones aún logran separarse de sus átomos y, durante algún tiempo, liberarse del enlace con el núcleo. Por lo tanto, existe una pequeña cantidad de electrones libres en un cristal de germanio, por lo que es posible conducir una corriente eléctrica. ¿Cuántos electrones libres existen en un cristal de germanio en condiciones normales?
No hay más de dos electrones libres de este tipo por 10 ^ 10 (diez mil millones) de átomos, por lo que el germanio es un mal conductor, o como es costumbre decir un semiconductor. Cabe señalar que solo un gramo de germanio contiene 10 ^ 22 (diez mil billones de billones) de átomos, lo que le permite "obtener" aproximadamente dos mil billones de electrones libres. Parece que es suficiente para pasar una gran corriente eléctrica. Para abordar este problema, es suficiente recordar qué corriente de 1 A.
Una corriente de 1 A corresponde a pasar a través de un conductor en un segundo una carga eléctrica de 1 Coulomb, o 6 * 10 ^ 18 (seis billones de billones) de electrones por segundo. En este contexto, es poco probable que dos mil millones de electrones libres, e incluso dispersos sobre un cristal enorme, aseguren el paso de altas corrientes. Aunque, debido al movimiento térmico, existe una pequeña conductividad en Alemania. Esta es la llamada conductividad intrínseca.
Conductividad electrónica y de agujeros
A medida que aumenta la temperatura, se transfiere energía adicional a los electrones, sus vibraciones térmicas se vuelven más enérgicas, como resultado de lo cual algunos electrones logran separarse de sus átomos.Estos electrones se liberan y, en ausencia de un campo eléctrico externo, hacen movimientos caóticos y se mueven en el espacio libre.
Los átomos que han perdido electrones no pueden hacer movimientos aleatorios, sino que solo oscilan ligeramente en relación con su posición normal en la red cristalina. Dichos átomos, que han perdido electrones, se llaman iones positivos. Podemos suponer que en lugar de los electrones arrancados de sus átomos, se obtienen espacios libres, que comúnmente se llaman agujeros.
En general, el número de electrones y agujeros es el mismo, por lo que un agujero puede capturar un electrón que está cerca. Como resultado, un átomo de un ion positivo vuelve a ser neutral. El proceso de combinar electrones con agujeros se llama recombinación.
A la misma frecuencia, los electrones se separan de los átomos, por lo tanto, en promedio, el número de electrones y agujeros para un semiconductor particular es igual, constante y dependiente de las condiciones externas, especialmente la temperatura.
Si se aplica un voltaje al cristal semiconductor, entonces se ordenará el movimiento de electrones, una corriente fluirá a través del cristal debido a su conductividad de electrones y huecos. Esta conductividad se llama intrínseca, ya se mencionó un poco más arriba.
Pero los semiconductores en su forma pura, que tienen conductividad electrónica y de agujero, no son adecuados para la fabricación de diodos, transistores y otros detalles, ya que la base de estos dispositivos es la unión p-n (léase "pe-en").
Para obtener dicha transición, se necesitan dos tipos de semiconductores, dos tipos de conductividad (p - positivo - positivo, agujero) y (n - negativo - negativo, electrónico). Estos tipos de semiconductores se obtienen por dopaje, agregando impurezas a los cristales puros de germanio o silicio.
Aunque la cantidad de impurezas es muy pequeña, su presencia en gran medida cambia las propiedades del semiconductor, le permite obtener semiconductores de conductividad diferente. Esto se discutirá en la siguiente parte del artículo.
Boris Aladyshkin, electro-es.tomathouse.com
Ver también en electro-es.tomathouse.com
: