Categorías: Electricistas novatos, Electricista industrial
Cantidad de vistas: 37528
Comentarios sobre el artículo: 0
La aplicación práctica de la electrólisis.
Cuando una corriente eléctrica pasa a través de una solución o una fusión de un electrolito, los electrodos disueltos u otras sustancias que son producto de reacciones secundarias en los electrodos se liberan en los electrodos. Este proceso fisicoquímico se llama electrólisis.
La esencia de la electrólisis.
En el campo eléctrico creado por los electrodos, los iones en el fluido conductor vienen en un movimiento ordenado. El electrodo negativo es el cátodo, el positivo es el ánodo.
Los iones negativos llamados aniones (iones del grupo hidroxilo y los residuos ácidos) corren hacia el ánodo, y los iones positivos llamados cationes (hidrógeno, metal, iones de amonio, etc.) corren hacia el cátodo.
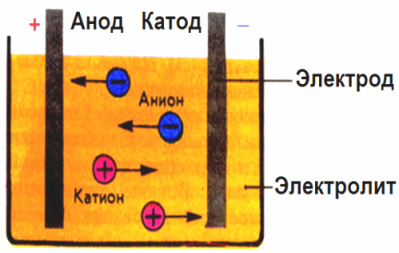
Se produce un proceso de oxidación-reducción en los electrodos: la reducción electroquímica de partículas (átomos, moléculas, cationes) ocurre en el cátodo, y la oxidación electroquímica de partículas (átomos, moléculas, aniones) ocurre en el ánodo. Las reacciones de disociación en un electrolito son reacciones primarias, y las reacciones que proceden directamente en los electrodos se llaman secundarias.
Las leyes de la electrólisis de Faraday.
La separación de las reacciones de electrólisis en primaria y secundaria ayudó a Michael Faraday a establecer las leyes de la electrólisis:
-
La primera ley de la electrólisis de Faraday: la masa de la sustancia depositada en el electrodo durante la electrólisis es directamente proporcional a la cantidad de electricidad transferida a este electrodo. Por cantidad de electricidad se entiende una carga eléctrica, medida, como regla, en colgantes.
-
La segunda ley de la electrólisis de Faraday: para una cantidad dada de electricidad (carga eléctrica), la masa de un elemento químico depositado en el electrodo es directamente proporcional a la masa equivalente del elemento. La masa equivalente de una sustancia es su masa molar dividida por un número entero, dependiendo de la reacción química en la que está involucrada la sustancia.
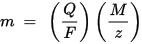
m es la masa de la sustancia depositada en el electrodo, Q es la carga eléctrica total que pasa a través de la sustancia F = 96,485.33 (83) C mol - 1 es la constante de Faraday, M es la masa molar de la sustancia (por ejemplo, la masa molar del agua H2O = 18 g / mol), z es el número de valencia de iones de una sustancia (el número de electrones por ion).
Tenga en cuenta que M / z es la masa equivalente de la sustancia precipitada. Para la primera ley de Faraday, M, F y z son constantes, por lo que cuanto mayor sea el valor de Q, mayor será el valor de m. Para la segunda ley de Faraday, Q, F y z son constantes, por lo que cuanto mayor sea el valor de M / z (masa equivalente), mayor será el valor de m.
La electrólisis se usa ampliamente hoy en la industria y en la tecnología. Por ejemplo, es la electrólisis la que sirve como uno de los métodos más efectivos para la producción industrial de hidrógeno, peróxido de hidrógeno, dióxido de manganeso, aluminio, sodio, magnesio, calcio y otras sustancias. La electrólisis se usa para tratar aguas residuales, en galvanoplastia, en galvanoplastia y finalmente en fuentes de corriente química. Pero lo primero es lo primero.
Obtención de metales puros a partir de minerales por electrólisis.
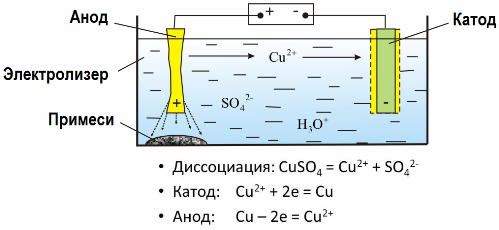
Gracias a la electrólisis, muchos metales se extraen de minerales y se someten a un procesamiento adicional. Entonces, cuando el mineral o el mineral enriquecido (concentrado) se trata con reactivos, el metal pasa a la solución y luego, mediante electroextracción, el metal se aísla de la solución. El metal puro se libera al mismo tiempo en el cátodo. De esta manera recibir zinc, cobre, cadmio.
Los metales se someten a electrorefinación para eliminar impurezas y convertir las impurezas contenidas en una forma conveniente para su posterior procesamiento. El metal a limpiar se moldea en forma de placas, y estas placas se usan como ánodos en la electrólisis.
Cuando la corriente pasa, el metal del ánodo se disuelve, pasa en forma de cationes a la solución, luego los cationes se descargan en el cátodo y forman un precipitado de metal puro. Las impurezas del ánodo no se disuelven: precipitan con el lodo del ánodo o pasan al electrolito, de donde se eliminan de forma continua o periódica.
Considera como un ejemplo electrorefinado de cobre. El componente principal de la solución, el sulfato de cobre, es la sal más común y más barata de este metal. La solución tiene una baja conductividad eléctrica. Para aumentarlo, se agrega ácido sulfúrico al electrolito.
Además, se introducen pequeñas cantidades de aditivos en la solución para facilitar la formación de un precipitado metálico compacto. En general, el cobre, el níquel, el plomo, el estaño, la plata y el oro están sujetos a refinación electrolítica.
Tratamiento de aguas residuales por electrólisis
La electrólisis se utiliza en el tratamiento de aguas residuales (procesos de electrocoagulación, electroextracción y electroflotación). El método de limpieza electroquímica es uno de los más utilizados. Para la electrólisis, se utilizan ánodos insolubles (magnetita, óxido de plomo, grafito, manganeso, que se depositan en una base de titanio) o solubles (aluminio, hierro).
Este método se utiliza para aislar sustancias orgánicas e inorgánicas tóxicas del agua. Por ejemplo, las tuberías de cobre se limpian a escala con una solución de ácido sulfúrico, y las aguas residuales industriales se deben limpiar por electrólisis con un ánodo insoluble. El cobre se libera en el cátodo, que nuevamente se puede utilizar en la misma empresa.
Las aguas residuales alcalinas se purifican por electrólisis a partir de compuestos de cianuro. Para acelerar la oxidación de los cianuros, aumentar la conductividad eléctrica y ahorrar energía, se utiliza un aditivo en forma de cloruro de sodio en el agua.
La electrólisis se lleva a cabo con un ánodo de grafito y un cátodo de acero. Los cianuros se destruyen durante la oxidación electroquímica y el cloro, que se libera en el ánodo. La efectividad de dicha limpieza es cercana al 100%.
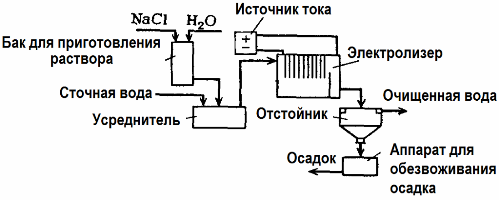
Además de la limpieza electroquímica directa, se puede incluir en el proceso de electrólisis. coagulación. Excluyendo la adición de sales, la electrólisis se realiza con ánodos solubles de aluminio o hierro. Entonces no solo se destruyen los contaminantes en el ánodo, sino que el ánodo mismo se disuelve. Se forman compuestos dispersos activos que coagulan (espesan) contaminantes coloidales dispersos.
Este método es efectivo en el tratamiento de aguas residuales de grasas, productos derivados del petróleo, colorantes, aceites, sustancias radiactivas, etc. Se llama electrocoagulación.
Galvanoplastia
La galvanoplastia es la deposición electrolítica de ciertos metales para proteger los productos de la corrosión y darles un aspecto estético apropiado (el revestimiento está hecho con cromo, níquel, plata, oro, platino, etc.). La cosa se limpia a fondo, se desengrasa y se usa como cátodo en un baño electrolítico en el que se vierte una solución salina del metal con el que es necesario recubrir el producto.
Se usa una placa del mismo metal como ánodo. Como regla general, se usa un par de placas de ánodo, y el sujeto a galvanizar se coloca entre ellas.
Electroformado
Galvanoplastia: la deposición de metal en la superficie de diferentes cuerpos para reproducir sus formas: moldes para fundir piezas, esculturas, clichés impresos, etc.

La deposición galvánica de metal sobre la superficie de un objeto solo es posible cuando esta superficie o todo el objeto es un conductor de corriente eléctrica, por lo que es aconsejable utilizar metales para hacer modelos o formas. Los metales fusibles son los más adecuados para este propósito: plomo, estaño, soldaduras, aleación de madera.
Estos metales son blandos, se procesan fácilmente con herramientas de metalistería, están bien grabados y fundidos. Después de construir la capa galvánica y terminar, el metal del molde se funde del producto terminado.
Sin embargo, las mayores oportunidades para la fabricación de modelos todavía están representadas por materiales dieléctricos. Para metalizar tales modelos, es necesario dar a su superficie conductividad eléctrica. El éxito o el fracaso en última instancia depende principalmente de la calidad de la capa conductora. Esta capa se puede aplicar de tres maneras.
La forma más común es grafitización, es adecuado para modelos de plastilina y otros materiales que permiten moler grafito en la superficie.
El siguiente truco es bronceado, el método es bueno para modelos de forma relativamente compleja, para diferentes materiales, sin embargo, debido al grosor de la capa de bronce, la transferencia de piezas pequeñas está algo distorsionada.
Y finalmente plateadoadecuado en todos los casos, pero especialmente indispensable para modelos frágiles con una forma muy compleja: plantas, insectos, etc.
Fuentes de corriente quimica
Además, la electrólisis es el proceso principal debido al cual funcionan las fuentes de corriente química más avanzadas, como las baterías y los acumuladores. Hay dos electrodos en contacto con el electrolito.
Se establece una diferencia de potencial entre los electrodos, una fuerza electromotriz correspondiente a la energía libre de la reacción redox. Vea aquí para más detalles: Fuentes químicas de corriente eléctrica.
Batería de limón (haga clic en la imagen para ampliarla)
La acción de las fuentes de corriente químicas se basa en la ocurrencia de procesos separados espacialmente con un circuito externo cerrado: en el ánodo negativo, el agente reductor se oxida, los electrones libres que se forman pasan a través del circuito externo al cátodo positivo, creando una corriente de descarga, donde participan en la reacción de reducción de oxidación. Por lo tanto, el flujo de electrones cargados negativamente a lo largo del circuito externo va del ánodo al cátodo, es decir, del electrodo negativo al positivo.
Ver también en electro-es.tomathouse.com
: